人民金融·创新药指数涨0.53% | ASCO年会ADC成焦点 国产ADC药物繁华背后有隐忧
在刚结束的2022 ASCO年会上,ADC技术备受瞩目,明星药物Enhertu再度大放异彩,国产ADC也公布了靓丽的研究数据。当前,国内企业研发ADC药物的热情空前高涨,传统药企巨头、生物技术公司都纷纷布局。但热闹的背后,是国内ADC药物同质化研发严重,且在研品种以一代药物的me-too为主,面对best-in-class搅局者的闯入,将有不小的挑战。
在6月3日至6月9日的新发布周期内,信达生物和驯鹿医疗合作的伊基仑赛注射液上市申请获受理,这是首款在国内申报上市的靶向BCMA的CAR-T疗法;同时,来自和铂医药、嘉葆药银、君实生物等的7个创新药项目首次获批临床,我们将其纳入了“人民金融·创新药指数”。目前,“人民金融·创新药指数”的成分样本共有1437个。
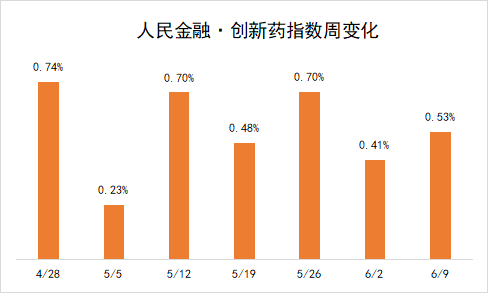
受这些因素推动,新发布周期内,“人民金融·创新药指数”上涨了0.53%,最新报2699.81点。
国产ADC药物繁华背后有隐忧
一年一度的ASCO(美国临床肿瘤学)年会,是全球药企一同秀肌肉的时候。在刚结束的2022 ASCO年会上,更新最多、数据最亮眼的非抗体偶联药物(ADC)莫属。
这其中,第一三共和阿斯利康共同研发的Enhertu(DS-8201)万众瞩目。在本届ASCO上,Enhertu公布了其针对HER2低表达患者并获得阳性结果的3期试验,这是名副其实的重大突破。
第一三共和阿斯利康汇报的DESTINY-Breast 04研究结果显示,与化疗方案相比,Enhertu将HR阳性、HER2低表达转移性乳腺癌患者的疾病进展或死亡风险降低了49%;在评估的所有患者中,Enhertu与化疗相比,将患者的中位总生存期延长了6个月以上。
这意味着,Enhertu成为首个被证明能够为HER2低表达患者群体带来生存获益的HER2靶向疗法。基于此,业内预期Enhertu将重塑HER2低表达乳腺癌治疗模式,甚至改写疾病分类标准。
也是在本届ASCO上,国内ADC先行者荣昌生物、乐普生物、科伦药业也公布了其ADC产品最新研究结果。
其中,荣昌生物的维迪西妥单抗带来了3项尿路上皮癌的临床数据,在HER2乳腺癌竞争日趋白热化的当下,开辟了尿路上皮癌的蓝海市场。或许与ASCO公布的数据有关,近期荣昌生物A股股价强势反弹,6月以来累计涨幅超过40%,领涨本土上市创新药企。
ADC,即抗体偶联药物,是由抗体、毒素和连接子组成的创新药物,可以精准将毒素递送至肿瘤细胞,从而发挥杀伤作用,故而被称为“生物导弹”。
近年来,ADC技术成为全球抗肿瘤药技术的热点研发方向。据统计,目前全球有13款ADC药物获批上市,临床活跃药物超100款。据NatureReviewsDrugDiscovery发文分析,预计2026年,全球ADC药物市场规模将达164亿美元。
面对这样一个前景巨大的市场,国内企业的研发热情也空前高涨,传统药企巨头、生物技术公司都纷纷布局。走在最前沿的荣昌生物、科伦药业、乐普生物等正呈你追我赶之势,去年以来天士力、华东医药、珍宝岛等传统药企也跨界入局ADC,今年基石药业、复旦张江等创新药企也迎来了首个获批临床或IND受理的ADC药物。
不过,热闹背后,逐渐拥挤的靶点为ADC药物的市场前景蒙上了一层阴影。
据我们不完全统计,目前国内处于临床阶段或IND受理阶段的ADC药物有60多款,其中约40%以HER2为靶点,约12%以TROP2为靶点。显然,此类靶点赛道已经较为拥挤,产品上市后将面临较为残酷的竞争格局。
同时,在研ADC项目还面临着技术迭代的风险,不少项目虽处于早期临床,但其实已沦为“前浪”。根据中信证券研报数据,截至2021年底,国内在研HER2 ADC便多达22款,且大部分在研ADC药物多是以第一代ADC药物恩美曲妥珠单抗为蓝本,目标是成为恩美曲妥珠单抗的me-too或me-better产品。
此外,国内ADC领域即将上演“狼来了”的故事。有着ADC领域“天花板”之称的Enhertu已在今年3月提交了国内上市申请并在5月纳入优先审评,这意味着从2023年开始国内ADC企业或将直面全球顶尖ADC产品的竞争,如何在Enhertu的攻势下突围,将成为考验国内企业的重大挑战。
国内首款BCMA CAR-T申报上市
近日,信达生物和驯鹿医疗合作的伊基仑赛注射液上市申请获CDE受理,且被拟纳入优先审评审批,适应症为既往接受三线或以上系统性治疗后复发或难治性多发性骨髓瘤成人患者。这是首款在国内申报上市的靶向BCMA的CAR-T疗法。
根据信达生物官微的介绍,伊基仑赛注射液(研发代号:IBI326/CT103A)由信达生物和驯鹿生物联合开发,已于2021年2月获得国家药品监督管理局药品审评中心(CDE)授予“突破性治疗药物(BTD)”认定。
此次NDA的递交是基于伊基仑赛注射液一项1/2期注册性临床(NCT05066646)的研究结果。去年12月,信达生物与驯鹿医疗在2021年第63届美国血液学会(ASH)年会上报告了这项注册临床研究结果,研究数据显示,伊基仑赛注射液拥有极佳的安全性和有效性,ORR为94.9%,完全缓解/严格意义的完全缓解(CR/sCR)为58.2%。
信达生物表示,伊基仑赛注射液的海外开发布局正在积极进行中。2022年2月,伊基仑赛注射液获得美国食品药品监督管理局(FDA)授予“孤儿药”认定,用于治疗复发/难治性多发性骨髓瘤。同时,伊基仑赛注射液也在扩展适应症。上个月,伊基仑赛注射液新增抗体介导的视神经脊髓炎谱系疾病的临床试验申请已获国家药品监督管理局受理。
值得一提的是,今年2月底,传奇生物的西达基奥仑赛美国上市申请获FDA批准,成为中国首个获FDA批准的细胞治疗产品,及全球第二款获批靶向BCMA的CAR-T细胞免疫疗法。在国内,目前尚没有BCMA靶向CAR-T疗法获批上市,伊基仑赛早于西达基奥仑赛报产,有望成为国内获批的首款BCMA靶向CAR-T疗法。
7个创新药项目首次获批临床
在新发布周期内,来自和铂医药、嘉葆药银、君实生物等的7个创新药项目获批临床,包括4个生物药、3个化药,我们将其纳入了“人民金融·创新药指数”。目前,“人民金融·创新药指数”的成分样本共有1437个。
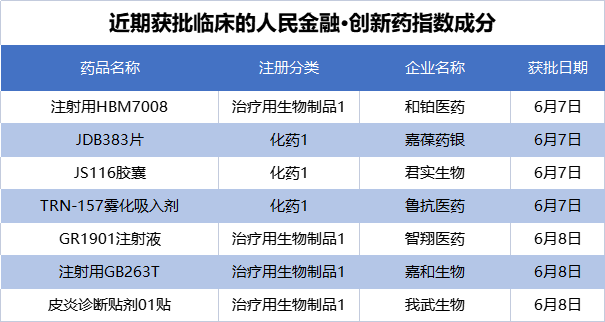
其中,嘉和生物的注射用GB263T于6月8日获批临床,适应症为晚期非小细胞肺癌及其他实体瘤。据介绍,GB263T是全球首个EGFR/cMET/cMET三特异性抗体,靶向EGFR和两个不同cMet表位。体外研究及体内动物模型已经证明了其显著的抗肿瘤活性。5月18日,GB263T已在澳大利亚开展的首次人体临床试验(FIH)中完成首位患者给药。
和铂医药申报的注射用HBM7008于6月7日获批临床,拟定适应症为晚期实体瘤。公开资料显示,HBM7008是和铂医药开发的一款同类首创同时靶向肿瘤抗原B7H4和4-1BB的双特异性抗体。该药已经于近日在澳大利亚完成1期临床试验首例患者给药。
君实生物此次取得临床批件的JS116胶囊为一款KRAS G12C小分子抑制剂,将开展KRAS G12C突变的晚期实体瘤临床试验。君实生物表示,KRAS基因突变有不同的亚型,其中KRAS G12C占所有KRAS突变的44%,在非小细胞肺癌中最为常见。临床前研究表明,JS116具有较宽的安全窗,良好的有效性和安全性,有望成为安全、高效的精准靶向治疗药物。目前,全球仅有一款针对KRASG12C的靶向药Lumakras获批上市,国内尚无KRAS G12C小分子抑制剂获批上市。
(文章来源:证券时报网)
本文来源于网友自行发布,不代表本站立场,转载联系作者并注明出处
